Su Definición
La palabra Polímero viene del griego:
poli = muchos, varios
mero = unidad de repetición o unidad fundamental
Un polímero es una cadena de unidades de repetición o monómeros (del griego mono=uno, unidad) que se unen y repiten formando una macro-molécula (decenas de millones de unidades repetidas) o polímero.
Sin embargo antes de entender un polímero es importante entender cómo se forma y esto es a partir de moléculas.
Una molécula es un grupo eléctricamente neutro de dos o más átomos unidos por enlaces.Las moléculas se distinguen de los iones por su falta de carga eléctrica.
Los átomos más comunes formando resinas plásticas son 3: carbono, cuyo símbolo químico es C con 4 enlaces, Hidrógeno, cuyo símbolo químico es H y tiene un enlace y Oxígeno, cuyo símbolo químico es O con 2 enlaces.
Existen otros átomos menos comumnes como el cloro (Cl) que es un elemento importante en la molécula del PVC.
El carbono es posiblemente el átomo más importante en la formación de las resinas plásticas ya que forma lo que viene siendo la columna vertebral tomando 2 enlaces para unirse un carbón con otro y dejando 2 enlaces para unirse a otros átomos.
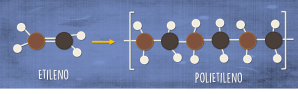
En el siguiente ejemplo podemos ver la molécula del etileno (CH2=CH2), estas moléculas al ser sometidas a presión y temperatura dentro de un reactor, se unirán formando el polímero de polietileno, a este proceso se le conoce como polimerización.
Existen varias clases de polímeros como los plásticos, hules y fibras. Las características que diferencian a los polímeros son:
- El tipo de monómero(s);
- El número de monómeros o unidades repetidas;
- El tipo de conexión entre monómeros;
- Cómo se ramifícan sus cadenas
- ¿Cómo se elaboran los Polímeros?
Los polímeros se elaboran de diferentes fuentes de materia prima, esta puede ser de fuente natural como la celulosa, el etanol mejor conocido como alcohol etílico, el hule, etc.
Gas Natural y Carbón:
El gas natural es una fuente de materia prima en la elaboración de polímeros de este se desprende el etileno del que se forma el polipropileno y el metano que se transforma en formaldehido del que se elaboran las resinas fenólicas.
Del alquitrán se consigue el benceno, que se transforma a fenol que finalmente se puede transformar en poliuretano y poliestireno.
Del coque se extae el acetileno del cual también se puede utilizar para conseguir etileno y producir polietileno y cloruro de vinilo para producir cloruro de polivinilo, mejor conocido como PVC por sus siglas en inglés.
Petróleo:
Del petróleo se extrae la nafta, esta tal vez es es la fuente más importante de materia prima en la elaboración de polímeros, a continuación un esquema de todos los productos derivados del petróleo en dónde se puede observar la base de de varios polímeros comunes en el mercado.
El carbono es posiblemente el átomo más importante en la formación de las resinas plásticas ya que forma lo que viene siendo la columna vertebral tomando 2 enlaces para unirse un carbón con otro y dejando 2 enlaces para unirse a otros átomos.
En el siguiente ejemplo podemos ver la molécula del etileno (CH2=CH2), estas moléculas al ser sometidas a presión y temperatura dentro de un reactor, se unirán formando el polímero de polietileno, a este proceso se le conoce como polimerización.
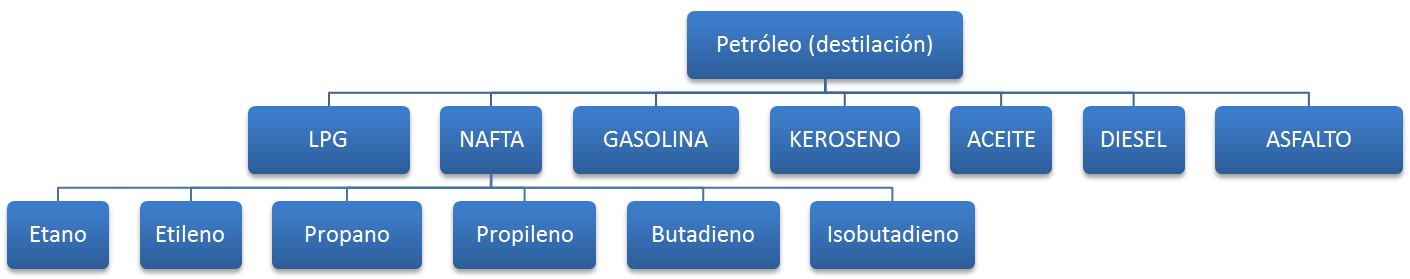
La Nafta se somete un proceso químico llamado craqueo o cracking por el cual se quiebran sus moléculas para así producir compuestos más simples como los del esquema de arriba.
Polimerización:
Una vez que se tienen los monómeros se procede a la polimerización, existen diferentes tipos de reacción de polimerización, aquí una lista de los más comunes:
Polimerización en Cadena – Un monómero es activado y la polimerización se propaga por activación de los monómeros vecinos. El proceso es muy rápido y polímeros de alto peso molecular se pueden lograr rápidamente por este proceso.
Polimerización por Pasos – Mecanismo en el cual monómeros bi-funcionales o multi-funiconales reaccionan para formar primero dimeros, luego trimeros, oligómeros y finalmente polímeros de cadena larga. Polímeros que se producen en pasos entre otros son los poliésteres, poliamidas (nylon) y poliuretanos.
Polimerización Interfacial – Es un tipo de polimerización en pasos en donde la polimerización ocurre en una interface entre la solución acuosa que contiene uno de los monómeros y una solución orgánica con el segundo monómeros. El polímero más común hecho por este método es la poliamida (nylon), en donde la diamina y el cloruro diácido reaccionan para formar la poliamida y ácido clorhídrico.
Polimerización en Masa – Se da la agregar un iniciador o catalizador a un monómero en estado líquido. Este iniciador se disuelve en el monómero. La reacción se inicia al calentar o exponer a radiación. Conforme la reacción ocurre la mezcla se torna más viscosa, la reacción es exotérmica y puede producir un amplio rango de masas moleculares.
Polimerización por Emulsión – La polimerización en emulsión es un tipo de polimerización radical que generalmente comienza con una emulsión incorporando agua, monómero y un tenso-activo (surfactante). El tipo más común de polimerización en emulsión es una emulsión de aceite en agua, en la que la gotitas de monómero (el aceite) se emulsionan (con tenso-activos) en una fase continua de agua. También se pueden usar polímeros solubles en agua, tales como ciertos alcoholes polivinílicos o hidroxietil-celulosas, para actuar como emulsionantes o estabilizadores. El nombre de «polimerización en emulsión» es un nombre inapropiado que surge de un error histórico. En lugar de producirse en gotitas de emulsión, la polimerización tiene lugar en las partículas de látex que se forman espontáneamente en los primeros minutos del proceso.
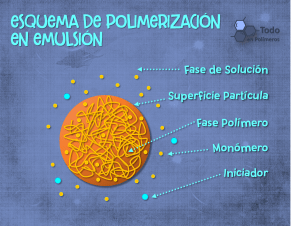
Las partículas se pueden detener de coagularse entre sí porque cada partícula está rodeada por el tenso-activo (‘jabón’); la carga sobre el tenso-activo repele otras partículas electrostáticamente. Cuando se usan polímeros solubles en agua como estabilizadores en lugar de jabón, la repulsión entre partículas surge porque estos polímeros solubles en agua forman una «capa ramificada» alrededor de una partícula que repele a otras partículas, ya que empujar las partículas juntas implicaría comprimir estas cadenas.
Mecanismo
- Se dispersa (emulsiona) un monómero en una solución de surfactante y agua formando gotitas relativamente grandes de monómero en agua.
- El exceso de surfactante crea micelas en el agua.
- Pequeñas cantidades de monómero se difunden a través del agua hasta la micela.
- Se introduce un iniciador soluble en agua en la fase acuosa donde reacciona con el monómero en las micelas.
- El área superficial total de las micelas es mucho mayor que la superficie total de las gotas de monómero, por lo tanto, el iniciador reacciona típicamente en la micela y no en la gotita de monómero.
- El monómero en la micela se polimeriza rápidamente y la cadena en crecimiento termina. En este punto la micela hinchada de monómero se ha convertido en una partícula de polímero.
- Más monómero derivado de las gotitas se difunde a la partícula en crecimiento, donde más iniciadores eventualmente reaccionarán.
- Finalmente, las gotitas de monómero libre desaparecen y todo el monómero restante se encuentra en las partículas.
- Dependiendo del producto en elaboración y del monómero, se pueden añadir continua y lentamente más monómero e iniciador para mantener sus niveles en el sistema a medida que crecen las partículas.
La polimerización en emulsión se utiliza para fabricar varios polímeros comercialmente importantes. Muchos de estos polímeros se utilizan como materiales sólidos y deben aislarse de la dispersión acuosa después de la polimerización. En otros casos, la dispersión misma es el producto final. Una dispersión resultante de la polimerización en emulsión es a menudo llamada látex (especialmente si se deriva de un hule sintético) o una emulsión (aunque «emulsión» se refiere estrictamente a una dispersión de un líquido inmiscible en agua).
Ejemplos de polímeros producidos por emulsión son:
- Hule sintético de estireno butadieno (SBR) (algunos grados)
- Polibutadieno
- Policloropreno (Neopreno)
- Hule Nitrilo
- Hule Acrílico
- Cloruro de Polivinilo (PVC) (algunos grados)
- Poliestireno – algunos grados
- Polimetil-metacrilato, acrílico (PMMA) (algunos grados)
- Acrilonitrilo Butadieno Estireno (ABS)
- Fluoruro de Polivinilideno (PVDF)
- Tetrafluoroetileno (PTFE o Teflon®)
- Dispersiones acuosas de acetato de polivinilo, latex acrílico, etc.
Polimerización por Suspensión – Esta es una polimerización radical heterogenea que utiliza agitación mecánica para mezclar un monómero o mezcla de monómeros en una fase líquida, como el agua, mientras que los monómeros se polimerizan van formando esferas de polímero.
Este proceso es usado en la producción de varias resinas comerciales tales como enl cloruro de polivinilo (PVC), resinas estirénicas tales como el poliestireno, poliestireno expandido, poliestireno de alto impacto así como poli-estireno acrilonitrilo y polimetil metacrilato (mejor conocido como acrílico).
Polimerización por Condensación – Esta es una reacción química de crecimiento por pasos, en la que se combinan dos o más monómeros (moléculas pequeñas), con la formación de un sub-producto cada que se unen dos monómeros. En muchos casos, este sub-producto es agua u otra sustancia simple. A esta reacción se le conoce como reacción de condensación.
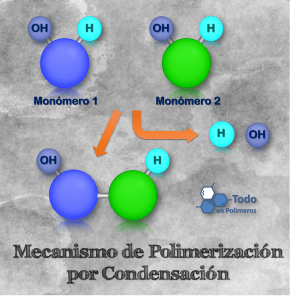
Los polímeros de condensación son aquellos formados por esta reacción, tales como un alquídico, fenol formaldehído o resinas fenólicas. A los polímeros de condensación pierden ciertos átomos presentes en el monómero del que se formaron.
A diferencia de los polímeros de condensación, los de adición no pierden estos átomos debido a que se forman de monómeros insaturados.
Los polímeros de condensación incluyen a las poliamidas (nylon), los poliacetales (acetales, POM) y los poliésteres.
El tipo de producto resultante depende del número de grupos funcionales que pueden reaccionar en el monómero. Los monómeros con sólo un grupo reactivo terminan una cadena en crecimiento, y por lo tanto dan productos finales con un peso molecular más bajo. Los polímeros lineales se crean usando monómeros con dos grupos finales reactivos y los monómeros con más de dos grupos reactivos dan polímeros tridimensionales reticulados.
La síntesis de deshidratación a menudo implica la unión de monómeros con un grupo -OH (hidroxilo) y un -H libremente ionizado en cada extremo (tal como un hidrógeno del -NH2 en el nylon o en proteínas). Normalmente, se utilizan dos o más monómeros diferentes en la reacción. Los enlaces entre el grupo hidroxilo, el átomo de hidrógeno y sus respectivos átomos rompen formando agua a partir del hidroxilo e hidrógeno, y el polímero.
El poliéster se crea a través de enlaces de éster entre monómeros, que implican los grupos funcionales carboxilo e hidroxilo (un ácido orgánico y un monómero de alcohol).
El nylon es otro polímero de condensación común. Puede fabricarse haciendo reaccionar di-aminas con derivados de carboxilo. En este caso, el derivado es un ácido di-carboxílico, pero también se usan cloruros de di-acilo. Otro método utilizado es la reacción de monómeros di-funcionales, con una amina y un grupo de ácido carboxílico sobre la misma molécula.
Los polímeros de condensación, a diferencia de los polímeros de adición, pueden ser biodegradables. Los enlaces peptídicos o éster entre monómeros pueden hidrolizarse mediante catalizadores ácidos o enzimas bacterianas que rompen la cadena polimérica en partes más pequeñas.
En general, los polímeros de condensación se forman más lentamente que los polímeros de adición, a menudo requieren calor. Por lo general tienen menos peso molecular. Los monómeros se consumen temprano en la reacción; los grupos funcionales terminales permanecen activos durante la reacción y cadenas cortas se combinan para formar cadenas más largas. Se requiere un alto índice de conversión para lograr altos pesos moleculares según la ecuación de Carothers.

